ネタのタネ
世界初、iPS-NKT細胞を血管内に直接投与 頭頸部がんの免疫細胞療法で治験を開始
by 国立大学法人千葉大学
- 提供:PR TIMES
2020年6月25日に医薬品医療機器総合機構(PMDA)の30日調査を終え、千葉大学病院(病院⾧ 横手幸太郎)では、頭頸部がんの新たな治療法として、がんに対して強い攻撃力を持つ免疫細胞「NKT細胞」を用いた治療法の開発を進めてきましたが、このたび、さらなる生存率の改善に向けて、理化学研究所と連携し、iPS細胞からNKT細胞を作製した「iPS-NKT細胞」をヒトに投与する、世界初の治療法を医師主導治験として行うこととなりました。
これまでに「iPS-NKT細胞」が人の血管内に直接投与されたことはなく、本治験で忍容性(副作用などの発現状況を評価して適切な投与量を検討)、安全性、有効性が確認されれば、頭頸部がん(鼻、口、喉、上顎、下顎、耳などにできるがん)と闘っている患者さんにとって大きな希望となります。
NKT細胞の特徴
リンパ球の一種で、がんに対して強い攻撃力を持つが、人の血液中にわずかしか存在せず(0.01%程度)、個人差も大きく、実用化へのハードルが高かった。
iPS-NKT細胞
iPS細胞からNKT細胞を分化・作製した細胞。高機能を備えたままの細胞を増殖可能。頭頸部がんに直接投与することで高い治療効果と実用性が期待される。
治験責任医師および治験調整医師より
iPS-NKT細胞は、NKT細胞の抗腫瘍効果を担がん状態でも最大限発揮できるように開発されたiPS細胞由来のNKT細胞です。本治験は、これを用いて行う世界初の臨床試験です。本治験の主目的は安全性の確認ですが、有効性についても期待を持って臨みたいと思います。
本治験の概要
(1) 試験名
「再発・進行頭頸部がん患者を対象としたiPS-NKT細胞動注療法に関する第1相試験」
(2) 目的
これまでに「iPS-NKT細胞」が人の血管内に直接投与された経験はないことから、本治験では、人に対する「iPS-NKT細胞」の忍容性、安全性(どのような有害事象がどの程度発現するのか)、そして有効性について評価することを目的としています。
(3) 試験デザイン
単施設、非盲検、非対照、用量漸増試験
(4) 対象疾患
標準治療後又は標準治療の適応とならない再発・進行頭頸部がん
(5) 対象被験者数
4~18名(副作用の発現状況による)※詳細は千葉大学病院 耳鼻咽喉・頭頸部外科HPに掲載予定
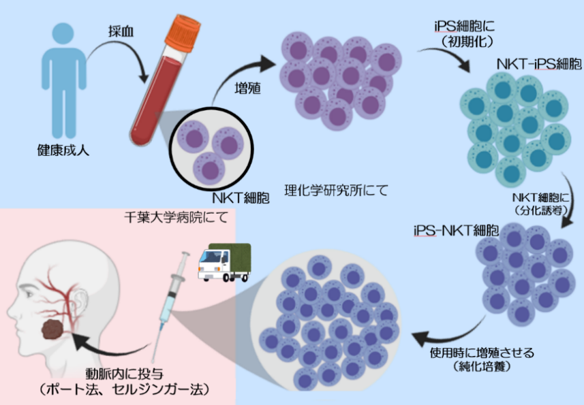
(6) iPS-NKT細胞投与までの流れ
1. 本治験への参加に関する説明を行い、同意をいただきます。
2. 本治験への参加が可能か、検査等で確認します(スクリーニング)。
3. 治療スケジュールを計画し、理化学研究所に「iPS-NKT細胞」の製造(上図)を依頼。
4. 投与方法を検討し、必要に応じて予め局所麻酔での投与経路作成手術を行います。
5. 理化学研究所で製造された「iPS-NKT細胞」が、医師により投与されます。
(7) 本治験の実施体
〇 治験責任医師
千葉大学医学部附属病院 耳鼻咽喉・頭頸部外科 飯沼 智久
〇 治験調整医師(代表)
千葉大学大学院医学研究院 免疫細胞医学 本橋 新一郎
〇 治験製品製造及び提供責任者
国立研究開発法人 理化学研究所 生命医科学研究センター 古関 明彦
〇 治験実施支援(調整事務局、モニタリング、データマネジメント、統計解析など)部門
千葉大学医学部附属病院 臨床試験部 花岡 英紀
〇 HLA検査、抗HLA抗体検査及びサイトカイン検査
ジェノダイブ株式会社、株式会社LSIメディエンス
(8) 本研究への支援
本研究は、下記機関及び企業より支援を受けて実施します。
● 国立研究開発法人 日本医療研究開発機構(AMED)
・再生医療実現拠点ネットワークプログラム 疾患・組織別実用化研究拠点(拠点B)
「NKT細胞再生によるがん免疫治療技術開発拠点」
・再生医療実用化研究事業
「再発・進行頭頸部がん患者を対象としたiPS-NKT細胞動注療法に関する第1相試験」
研究代表者:国立研究開発法人 理化学研究所 生命医科学研究センター 古関 明彦
● ブライトパス・バイオ株式会社
経過
平成25年 2月14日 頭頸部がんに対する「NKT療法」が先進医療Bとして承認
平成27年 2月 4日~ 医薬品医療機器総合機構(以下、「PMDA」)と 「iPS-NKT細胞」の品質、安全性等に関する相談を開始
平成30年 12月27日 PMDAと「iPS-NKT細胞」に関する治験相談を実施
令和 2年 5月20日 千葉大学医学部附属病院治験審査委員会にて承認
令和 2年 5月27日 厚生労働大臣に治験届を提出
令和 2年 6月25日 PMDAの30日調査終了見込み
企業プレスリリース詳細へ
PR TIMESトップへ